常識にとらわれない新しい発想で医療に貢献する
バイオマテリアルが対象とする研究範囲は大変広く、多分に学際的といえます。
マテリアルですから材料工学、化学、物理がベースと成っていることは言うまでもないでしょう。応用対象が生体であるため、生物学や医学の知識も必要です。生体計測やイメージング、シミュレーションなどの医工学分野では情報学やコンピュータの助けも必要かもしれません。そのような幅広い研究対象の中で、私の研究室で興味を持って取り組んでいるいくつかのテーマについて紹介します。
本研究室では高分子化学に立脚し、一般的な常識にとらわれない新しい発想で医療に貢献するような材料開発に関わる研究を順次拡大していく予定です。
再生医療用材料の設計
近年、再生医療の研究が非常に活発になってきており、iPS細胞を含めた様々な幹細胞を用いた組織の再生が報告されつつあります。
最近では本邦において世界初のiPS細胞による臨床研究 ( 加齢黄斑変性治療 ) が開始されました。
再生医療では、幹細胞の持つ能力を最大限に引き出すための足場材料の研究が重要です。たとえば、ポリ乳酸のスポンジなどが代表的な足場材料です。ポリ乳酸は生体内で分解されるため、細胞の増殖、機能化とともに生体内で消失し、再生組織に置き換わることが期待されます。
ただし、ポリ乳酸には、分解に時間がかかるということと、細胞親和性が低いという欠点があり様々な修飾を行うといった研究が盛んに行われています。また、機能性のタンパク質を足場材料に応用するといった研究も数多く行われています。たとえばある種類の細胞のみの増殖を促すタンパク質を組み込んだ分解性の足場などです。このように、幹細胞の増殖や分化はもちろん、生体内での分解性も制御できるような材料があれば、再生医療用足場材料として期待できるのです。
当研究室では、多糖類の分解性制御の研究を行っています。デキストランという生物由来の多糖類を、過ヨウ素酸で酸化すると、アルデヒド基が導入されます。このアルデヒド基はアミノ基と反応してシッフ塩基を形成するため、ポリアミンを架橋剤としたハイドロゲルができることがわかりました ( Hyon SH. et al., J. Biomed. Mater. Res A, 2014 ) 。面白いことに、このハイドロゲルは生体内で分解することがわかり、分解性はアルデヒドの量およびアミノ基の量で制御可能であることを報告しました ( Matsumura K. et al., Carbohydr. Polym., 2014 ) 。また、この機序がシッフ塩基形成が開始点となるMaillard反応による多糖類の主鎖切断であることを報告しています (図8) ( Chimpibul W. et al., J. Polym. Sci. A. 2016 ) 。
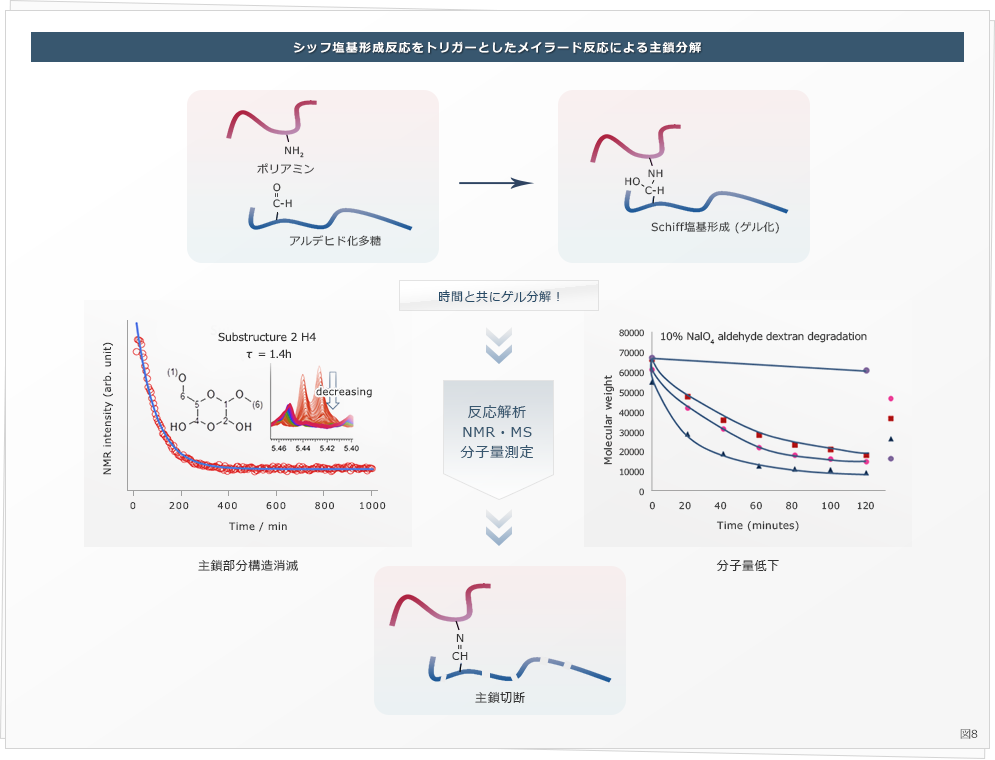

この現象を利用して、分解性を外部刺激 ( 近赤外光 ) により制御することで薬物の放出を制御することにも成功しました ( Nonsuwan, P et al., Carbohydr. Polym. 2019, Nonsuwan P, et al., ACS Appl. Polym. Mater. 2019 ) 。
次に我々は、この機序をセルロースに応用できないかと考えました。セルロースは、植物由来の多糖類材料であり、大量に存在し、用途の拡大が期待されている材料です。しかし、生体材料として考えると、生体内で分解しない、水への溶解性が無いなど、なかなか利用が困難でした。セルロースを過ヨウ素酸で酸化し、アルデヒド導入セルロースを作成し、成形することで生体内分解性のセルローススポンジを作成しました (図9) 。生体内での分解性は、アルデヒドの導入量によって制御可能であることを見いだしています。
これらの知見を利用することで、細胞培養用足場材料だけでなく、分解性の再生医療用インプラント、ドラッグデリバリー材料などへの幅広い応用が期待出来ます。
ドラッグデリバリーシステムに関する研究
物を適切な場所に送り届ける薬物送達技術や、生体内で必要な分量の放出を制御する薬物徐放技術など、ドラッグデリバリーシステムの研究は幅広く行われています。当研究室では、薬物の徐放技術や細胞内への送達技術について独自の観点から研究を行っています。
凍結濃縮を利用した細胞内への物質送達
細胞内にタンパク質や遺伝子を入れることは、細胞治療のためのドラッグデリバリーシステムの重要な課題です。細胞膜は疎水性の脂質二重膜から出来ており、容易に親水性の物質を透過させません。しかし、細胞はレセプターなどを利用してエンドサイトーシスという作用で細胞外から物質を取り込むことを行っています。
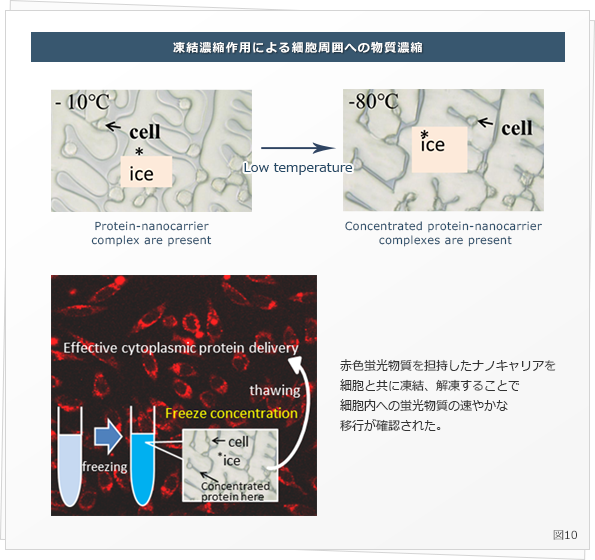
我々の研究室では、全く独自の観点からこの物質の細胞内への取り込み向上に成功しています。一般に、水溶液を凍結すると、氷結晶は純粋な水の結晶であるため、溶質成分を残存溶液部位の押し出すことで、残存水が濃縮されることが起こります。
これを凍結濃縮と呼び、ジュースの凍結時に、濃い部分と薄い部分に分かれる現象などで知られています。この現象を細胞懸濁液でも引き起こすことで、細胞周囲に物質を濃縮することが可能です。すなわち、細胞凍結保護物質の存在下で、細胞膜と親和性の高いナノキャリアに目的の物質を封入し、添加しておきます。その懸濁液を凍結すると、細胞が存在する残存水の濃度が急激に上昇します (図10) 。
その時に細胞周囲にナノキャリア複合体も濃縮され、細胞膜に吸着します。その後、解凍すると、細胞膜親和性のナノキャリアは細胞膜に吸着したままとなり、細胞はエンドサイトーシス作用により取り込みます。このように、一旦凍結するだけで細胞内に物質を効率よく取り込むことが出来るのです ( Ahmed S et al., Biomaterials 2014 ) 。
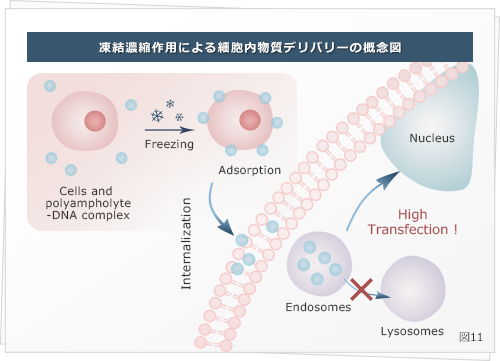
ナノキャリアに両性電解質高分子を組み込むことで、細胞が取り込んだ後、物質を消化するエンドソームから脱出する作用を付与する事が可能となり、目的部位への到達度の向上にも成功しました ( Ahmed S et al., Nanoscale 2016 ) 。
この手法は、抗原導入 ( Adv. Healthc Mater 2017 ) 遺伝子導入 ( ACS Biomater Sci Eng 2017 ) 、金ナノ粒子 ( Biomat Sci 2018 ) などの導入にも成功しています (図11) 。
基礎的な検討として、凍結保護物質に我々のポリマーを用いることでさらに高い凍結濃縮度が得られること ( Langmuir 2018 ) 、未凍結の低温においてリポソームへの金ナノ粒子の取り込みが向上する ( Langmuir 2019 ) など、興味深い知見が多く見つかっております。
高分子ナノキャリアの研究
次に、ドラッグデリバリーシステムの基材としての高分子の応用を紹介します。カチオン性のアミノ酸であるリジンとアニオン性のアミノ酸であるグルタミンをそれぞれ疎水性アミノ酸であるフェニルアラニンとNCA法によりブロックポリペプチドとします。それらは水溶液中でミセルを形成し、内部にそれぞれ別々の疎水性薬物を封入することが出来ます。その混合液において、カチオン性のミセルのみを架橋したゲルを作成します。そうすると、興味深いことにpHを変化させることでそれぞれのミセルから独立に薬物の放出を制御出来ることがわかりました ( Patel M et al., J. Mater. Chem B 2017 ) 。
酸性条件下もしくはアルカリ性条件下においてそれぞれ異なる薬物 (治療薬と抗菌薬) の放出を促進させることができることがわかり、これはラットにおける皮膚の創傷治癒効果を促進できることを示しました ( Patel M et al., J. Biomed. Mater. Res, 2019 ) 。
この他にも、pH依存性のナノキャリアや温度応答性の高分子など、いろいろな高分子材料を用いたDDSの研究を行っています。
生体組織と調和する生体材料の開発
生体組織そのものを人工材料と置換する場合、どのような点に注意が必要でしょうか?
生体は常に代謝を行っていて動的に生体分子の入れ替えが行われています。一方、人工材料は一度置換したらずっとそのままです。そのため生体と人工物の間には必ず界面が生じます。その界面を制御して生体適合性材料を創成することが重要な課題です。
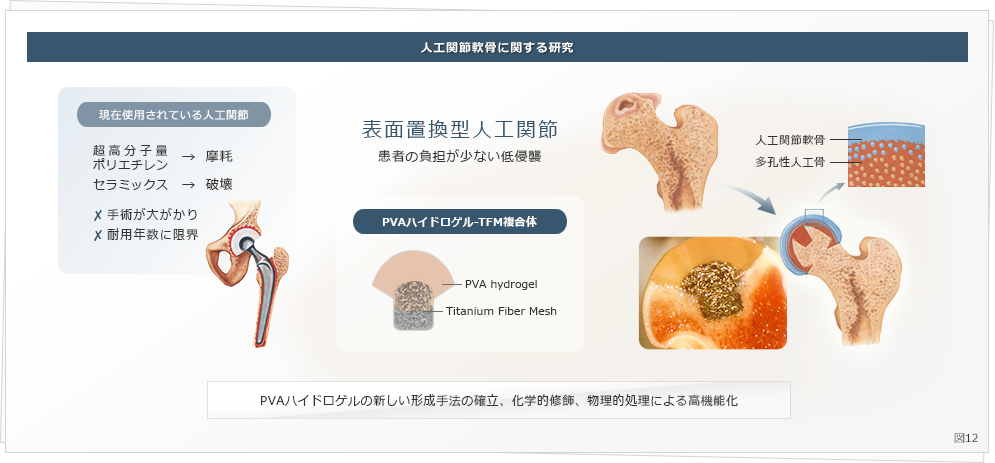
例えば、リウマチや事故などで関節に障害を受けた場合、現在では人工関節の置換術が行われています。この人工関節の施術は関節だけでなく大腿骨に金属のステムを埋め込む侵襲の大きな手術です。
関節表面のみの置換ですむような部分置換型の人工関節軟骨材料を研究しています。そのような材料には高強度、耐摩耗性。生体親和性など多くの機能が必要とされます。現在我々はポリビニルアルコール ( PVA ) ハイドロゲルをその材料として新規な作成手法や化学的、物理的手法により最適な物性の発現を目指しています (図12) 。
特にこれまで、透明かつ高強度のPVAハイドロゲルを作成するためには有機溶媒の使用が不可欠でしたが、本研究室では、ホットプレス法により有機溶媒を用いず、水のみで透明かつ高強度のゲル化を達成することを報告しました ( Sagkaguchi T. et al., Polymer J. 2017 ) 。
その他
上記のような高分子化合物を用いたバイオマテリアルに関する研究を幅広く行っていく予定です。
興味のある研究、やりたい研究があれば是非研究室で提案してください。一緒に考えていきましょう。

